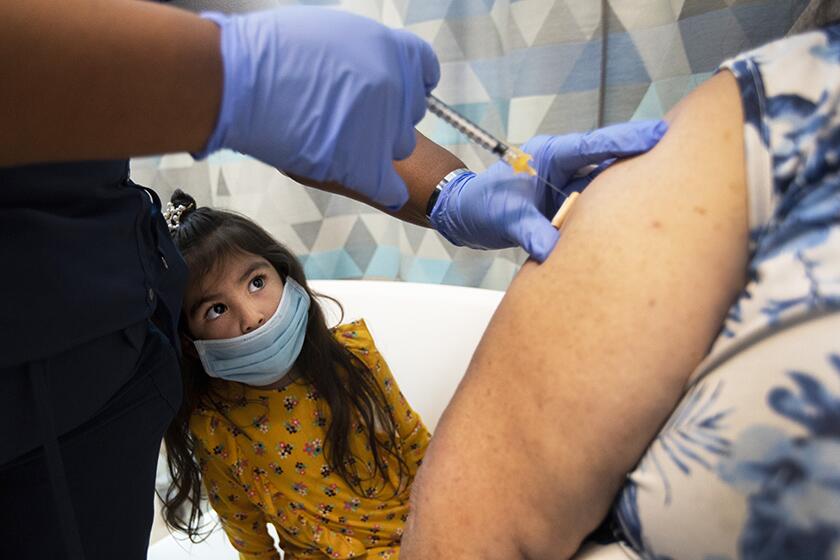
Pfizer pide a la FDA que autorice la vacuna contra COVID-19 para niños menores de 5 años
- Share via
WASHINGTON — Pfizer solicitó el martes a Estados Unidos que autorice dosis extra bajas de su vacuna contra COVID-19 para niños menores de 5 años, lo que podría abrir el camino para que los más pequeños del país comiencen a aplicarse las inyecciones a partir de marzo.
En un movimiento extraordinario, la Administración de Alimentos y Medicamentos (FDA por sus siglas en inglés) instó a Pfizer y su socio BioNTech a presentar su solicitud antes de lo que habían planeado las empresas.
Los 19 millones de niños menores de 5 años del país son el único grupo que aún no es elegible para la vacunación contra el coronavirus. Muchos padres han estado presionando para que se extiendan los antígenos a los menores en edad preescolar, especialmente porque la ola de Ómicron envió un número récord de niños pequeños al hospital.
Si la FDA está de acuerdo, las inyecciones de Pfizer, que contienen solo una décima parte de la dosis que se administra a los adultos, podrían administrarse a niños a partir de los 6 meses.
Una pregunta abierta es cuántas inyecciones necesitarán esos niños. Pfizer está probando tres inyecciones, ya que dos dosis extra bajas resultaron ser lo suficientemente fuertes para los bebés, pero no para los niños en edad preescolar, y los datos finales del estudio no se esperan hasta fines de marzo.
Eso significa que la FDA puede considerar si autoriza dos inyecciones por ahora, con la posibilidad de permitir una tercera dosis más adelante si el estudio la respalda.
Health officials say the rising numbers among children are the result of the rapid spread of the Omicron variant, which is much more easily transmitted than earlier strains of the coronavirus.
La decisión de la agencia podría llegar en unas semanas, pero ese no es el único obstáculo. Los Centros para el Control y la Prevención de Enfermedades (CDC por sus siglas en inglés) también tienen que aprobar la medida.
La administración Biden ha estado tratando de acelerar la autorización de las vacunas contra el COVID-19 para los niños, argumentando que los antígenos son fundamentales para abrir escuelas, así como guarderías; también lo son para liberar a los padres de las tareas en torno al cuidado de los hijos y que puedan volver a trabajar.
Sin embargo, las tasas de vacunación han sido más bajas entre los niños que en otros grupos de edad. Según la Academia Estadounidense de Pediatría, hasta la semana pasada, solo el 20% de los niños de 5 a 11 años, y poco más de la mitad de aquellos con una edad entre 12 y 17 años, estaban completamente inoculados. Casi las tres cuartas partes de los adultos se encuentran completamente vacunados.
Si bien los niños pequeños tienen muchas menos probabilidades que los adultos de enfermarse gravemente por el coronavirus, puede suceder, y las infecciones pediátricas de COVID-19 son más altas que en cualquier otro momento de la pandemia.
“Lo que estamos viendo en este momento todavía son muchas hospitalizaciones y, lamentablemente, algunas muertes en este grupo de edad”, señaló el Dr. Sean O’Leary de la Universidad de Colorado, quien forma parte del comité de enfermedades infecciosas de la Academia Estadounidense de Pediatría. Si la FDA aprueba los antígenos para estos niños, “será muy importante porque todas esas hospitalizaciones y muertes esencialmente se pueden prevenir”, señaló.
Para niños menores de 5 años, el estudio de Pfizer está dando a los participantes dos inyecciones con tres semanas de diferencia, seguidas de una tercera dosis al menos dos meses después. La compañía se encuentra haciendo la prueba para ver si se producen niveles de anticuerpos similares a los que se sabe que protegen a los adolescentes y adultos jóvenes.
A study of families in Israel finds that when parents are vaccinated against COVID-19, the protection they get extends to their children.
En diciembre, Pfizer anunció que los niños menores de 2 años parecían estar protegidos, pero que la respuesta de anticuerpos era demasiado baja en los pequeños de 2 a 4 años. No está claro por qué, pero una posibilidad es que la dosis extra baja fuera demasiado menor para los niños en edad preescolar.
Considerando que los resultados preliminares mostraron que las inyecciones eran seguras, Pfizer agregó una tercera dosis a la prueba con la esperanza de mejorar la protección.
Dado lo bien que funcionan los refuerzos para los grupos de mayor edad, “tiene sentido” que los niños más pequeños puedan beneficiarse de una tercera inyección, detalló O’Leary. “Ciertamente puedo entender de dónde proceden tanto la compañía como la FDA en términos de querer avanzar con esto, anticipando que habrá una tercera dosis en el futuro”.
Si quiere leer este artículo en inglés, haga clic aquí.
Suscríbase al Kiosco Digital
Encuentre noticias sobre su comunidad, entretenimiento, eventos locales y todo lo que desea saber del mundo del deporte y de sus equipos preferidos.
Ocasionalmente, puede recibir contenido promocional del Los Angeles Times en Español.